如何选择PVDF膜及NC膜?
Western Blot(蛋白质免疫印迹)是分子生物学和生物化学研究中不可或缺的技术,用于检测和定量特定蛋白质。在WB实验中,转印膜的选择对实验结果有着至关重要的影响。目前最常用的两种转印膜是聚偏二氟乙烯膜(PVDF)和硝酸纤维素膜(NC)。圣尔PVDF膜及NC膜在以下特性表现优异(价格优美):
- 蛋白结合能力
- 背景信号
- 化学兼容性
- 机械强度
- 操作便捷性
本文对PVDF膜及NC膜从基本特性,WB实验流程,相关实验试剂及耗材做详细介绍。
PVDF膜与NC膜的比较
基本特性对比
| 特性 | PVDF膜 | NC膜 |
|---|---|---|
| 化学组成 | 聚偏二氟乙烯 | 硝酸纤维素 |
| 蛋白结合机制 | 疏水作用和静电作用 | 疏水作用 |
| 蛋白结合能力 | 100-200μg/cm² | 80-100μg/cm² |
| 机械强度 | 高,柔韧不易破损 | 低,脆性易破损 |
| 化学稳定性 | 耐酸碱和有机溶剂 | 对酸碱和有机溶剂敏感 |
| 温度耐受范围 | -10℃至150℃ | -10℃至40℃ |
| 保质期 | 2年 | 3年 |
技术参数对比
| 参数 | PVDF膜 | NC膜 |
|---|---|---|
| 预处理要求 | 需甲醇活化(3-30秒) | 仅需蒸馏水润湿 |
| 孔径选择 | 0.2μm(小蛋白)<20kD 0.45μm(大蛋白)>20kD |
0.1μm(小蛋白):<7kD 0.22μm(小蛋白):10~20kD 0.45μm(大蛋白):>20kD |
| 厚度 | 0.45μm:140±20μm;0.2μm:180±20μm | 155μm |
| 背景信号 | 较高,需严格封闭 | 较低,信噪比优 |
| 重复使用性 | 可剥离抗体重复使用 | 一般不重复使用 |
| 适用检测方法 | 化学发光(ECL)、DAB显色 | 化学发光(ECL)、荧光检测 |
| 小分子蛋白保留 | 结合牢固不易丢失 | 洗涤时易丢失 |
PVDF膜与NC膜各自的优势
PVDF膜的主要优势
- 更高的蛋白结合能力:PVDF膜的蛋白结合量(100-200μg/cm²)比NC膜(80-100μg/cm²)高出约6倍,特别适合低丰度蛋白检测
- 优异的机械强度:PVDF膜柔韧耐用,可承受多次洗涤和抗体剥离操作,适合需要多次检测同一样本的实验
- 更好的化学稳定性:耐酸碱和有机溶剂,适用于苛刻的染色条件和多种检测方法
- 小分子蛋白保留能力强:对小于20kD的小分子蛋白结合更牢固,不易在洗涤过程中丢失
NC膜的主要优势
- 更低的背景信号:NC膜本身产生的背景非常低,可获得更清晰的结果和优异的信噪比
- 操作简便:无需甲醇活化,仅需蒸馏水润湿即可使用,减少了有毒试剂接触
- 更适合大分子蛋白:对大分子蛋白和蛋白质聚合物的吸附效果更好
- 成本较低:NC膜价格通常比PVDF膜低,适合大规模实验
应用场景选择指南
推荐使用PVDF膜的情况
- 检测小分子量蛋白(<20kD)
- 低丰度蛋白检测
- 需要多次抗体剥离和重新检测的实验
- 使用DAB显色的实验
- 需要长期保存的实验结果
- 涉及苛刻染色条件的实验
推荐使用NC膜的情况
- 检测大分子量蛋白(>20kD)和蛋白质聚合物
- 荧光Western Blot实验
- 需要最低背景信号的实验
- 初学者或需要简化操作流程的实验
- 大规模筛选实验(考虑成本因素)
- 亲水性蛋白的检测
专业建议:对于分子量在20kD左右的蛋白,两种膜均可使用,但需根据具体实验条件选择。PVDF膜通常需要更严格的封闭条件(如5%脱脂奶粉或3%BSA封闭1小时以上)来降低背景,而NC膜对封闭条件要求相对较低。
Western Blot实验标准流程
实验前准备
- 根据目标蛋白分子量选择适当孔径的膜:0.2μm用于小蛋白(<20kD),0.45μm用于大蛋白(>20kD)
- PVDF膜使用前需在甲醇中浸泡3-30秒活化,然后转移至转膜缓冲液平衡;NC膜仅需在蒸馏水中润湿后置于转膜缓冲液
- 准备适当浓度的SDS-PAGE凝胶:6%-15%分离胶,根据蛋白大小选择最佳分离范围
详细实验步骤
蛋白样品制备
使用裂解液(RIPA等)提取细胞或组织蛋白,加入蛋白酶抑制剂(PMSF)和磷酸酶抑制剂(根据需求)。离心去除不溶物,取上清进行蛋白定量(BCA或Bradford法)。用Loading Buffer稀释样品,煮沸5分钟使蛋白变性。
SDS-PAGE电泳
安装电泳装置,加入电泳缓冲液。按预定顺序上样,包括预染蛋白Marker。初始电压80V使样品通过浓缩胶,然后调至120V进行分离胶电泳,直至染料前沿到达凝胶底部。
转膜
准备转膜"三明治"结构:从负极到正极为海绵-滤纸-凝胶-膜-滤纸-海绵。确保无气泡。根据膜面积设置转膜条件:湿转法一般100V 1小时或30V过夜;半干转法根据膜面积设置电流和时间。
封闭
转膜完成后,用TBST洗涤膜5分钟。使用5%脱脂奶粉或3%BSA的TBST溶液室温封闭1小时,以阻断非特异性结合位点。
一抗孵育
用封闭液或TBST按推荐比例稀释一抗。将膜与一抗溶液4℃孵育过夜或室温孵育2小时。TBST洗涤3次,每次10分钟。
二抗孵育
用TBST按推荐比例稀释HRP标记的二抗。室温孵育1小时。TBST洗涤3次,每次10分钟。
显色与成像
按1:1比例混合ECL发光液的A液和B液,均匀覆盖膜表面。孵育1分钟后去除多余液体,用化学发光成像系统检测信号。
WB实验所需试剂与耗材清单(点击以下编号可直接进入详情页订购,页面下方关联部分产品,可直接选购)
主要试剂
- 细胞裂解液(RIPA等)SB-C008
- 蛋白酶抑制剂SB-WB016
- 磷酸酶抑制剂(根据需求)SB-WB017
- 蛋白定量试剂(BCA或Bradford法)SB-WB013
- SDS-PAGE Loading Buffer(还原型,5×)SB-PR037
- 丙烯酰胺/Bis溶液(30%)SB-ST003
- Tris-HCl缓冲液(pH 8.8和6.8)SB-WB112
- 预制胶SB-TG1000815
- 蛋白MarkerSB-WB009
- 电泳缓冲液(Tris-Glycine-SDS)SB-CPR006M
- 转膜缓冲液(Tris-Glycine或CAPS)SB-CPR037
- 封闭剂(脱脂奶粉或BSA)SB-PR079
- TBST缓冲液(TBS+0.1% Tween-20)SB-CPR009
- 一抗(针对目标蛋白)可自行在官网搜索
- HRP标记的二抗可自行在官网搜索
- ECL化学发光底物SB-WB004
- 丽春红染液(可选,用于转膜验证)SB-WB206
主要耗材与设备
常见问题解答(FAQ)
对于PVDF膜:大于20kD的蛋白选择0.45μm孔径,小于20kD的蛋白选择0.2μm孔径。对于NC膜:大于20kD的蛋白可用0.45μm,小于20kD的蛋白用0.22μm,小于7kD的极小蛋白可用0.1μm孔径。
PVDF膜是疏水性材料,甲醇浸泡可以去除膜表面的疏水层,使膜从白色不透明变为半透明,同时活化膜上的正电基团,增强与带负电荷蛋白的结合能力。活化时间通常为3-30秒,过长时间可能导致膜过度收缩。
不可以。NC膜接触甲醇会导致膜皱缩、卷曲,严重影响蛋白结合能力。NC膜只需用蒸馏水简单润湿后置于转膜缓冲液即可使用。
PVDF膜具有更高的蛋白结合能力,包括非特异性蛋白,因此需要更严格的封闭条件(如延长封闭时间或增加封闭剂浓度)来降低背景。NC膜本身非特异性结合较少,背景通常较低。
蛋白"转过头"指蛋白完全穿过膜未被截留。
解决措施包括:1)检查膜孔径是否合适;2)缩短转膜时间或降低电压;3)对于小蛋白可尝试0.1-0.2μm孔径的膜;4)使用PVDF膜因其截留率通常高于NC膜。
脱脂奶粉(5%)适用于大多数情况且成本低,但可能含有目标蛋白或磷酸化蛋白导致背景;BSA(3-5%)更纯净,适合磷酸化蛋白检测,但成本较高。对于PVDF膜,有时需要BSA来获得更好的封闭效果。
PVDF膜可以通过抗体剥离液(如pH2.0甘氨酸或β-巯基乙醇)去除结合的抗体,然后重新封闭和孵育新抗体。NC膜通常不建议重复使用,因其机械强度较差且在剥离过程中易损坏。
PVDF膜在荧光检测中会产生较高的自发荧光背景,而NC膜的自发荧光很低,能提供更好的信噪比。此外,荧光染料标记的二抗通常较大,与NC膜的兼容性更好。
显影后的膜可用保鲜膜包裹,4℃短期保存或-20℃长期保存。PVDF膜保存性能优于NC膜。对于需要重复检测的膜,可在TBST中4℃短期保存,但不宜超过1周。
可通过以下方法验证:1)使用预染蛋白Marker观察条带是否转移到膜上;2)用丽春红染色膜检测蛋白分布;3)检测内参蛋白(如GAPDH、β-actin)信号。转膜不充分通常表现为凝胶中残留蛋白(考马斯亮蓝染色可见)而膜上信号弱。
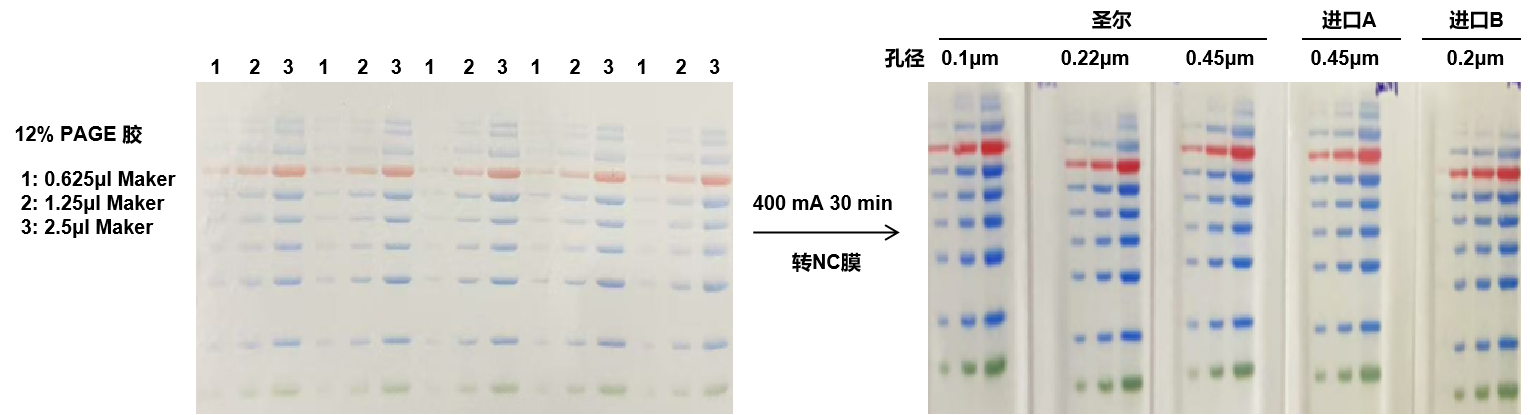
部分结果展示
PVDF膜测评
- 在相同实验条件下,将等浓度梯度的样本Marker进行电泳后同步转印至PVDF膜。
- 实验结果表明,圣尔share-bio(SB-WB308) PVDF膜的性能与进口膜相当,且甲醇激活只需3S,操作更方便。

NC膜测评
- 在相同实验条件下,将等浓度梯度的样本Marker进行电泳后同步转印至NC膜。
- 实验结果表明,圣尔share-bio三种孔径NC膜的性能与进口膜相当。此外,该NC膜在孵育后仍保持适中的软硬度,显著提升了实验操作的便利性。
最新PVDF膜测试数据
样品:Hela HEK-293 上样量:10μL/5μL/2.5 μL 样品:Hela HEK-293 上样量:10μL/5μL/2.5 μL
一抗:GAPDH 稀释比:1:8000 一抗:HSP90 稀释比:1:5000
二抗:山羊抗兔 稀释比:1:2000 二抗:山羊抗兔 稀释比:1:2000
曝光时间:2s 曝光时间:4s
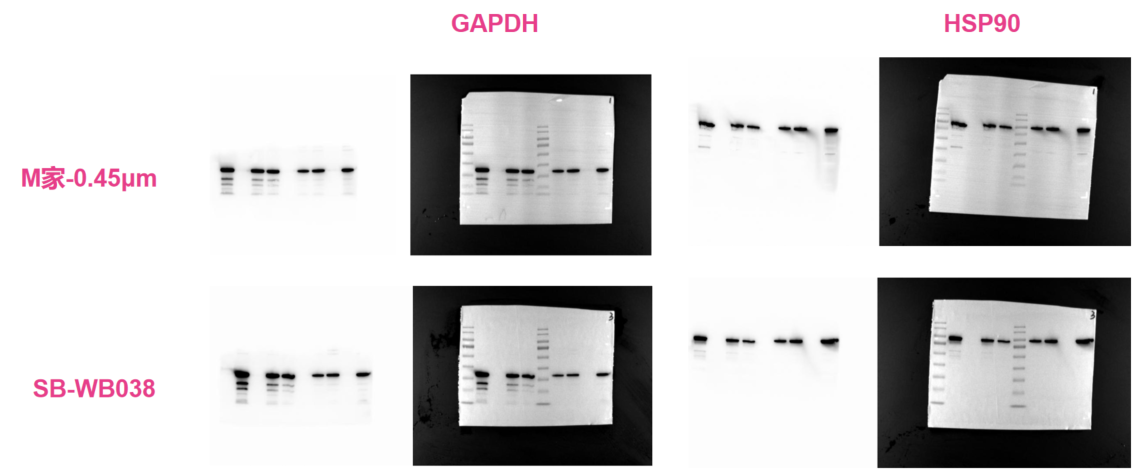
测试结果分析:
GAPDH内参WB结果显示,SB-WB038 PVDF转印膜在条带显影灵敏度和背景色上已经和M家PVDF膜无明显差异
HSP90蛋白WB结果显示,SB-WB038 PVDF转印膜在条带显影灵敏度和背景色上已经和M家PVDF膜无明显差异
